Durante estes últimos anos, desenvolveram-se e validaram-se novas ferramentas de amostragem, monitorização e diagnóstico nos suínos que resultem mais rápidas, simples e mais baratas.
Uma destas técnicas é a recolha e o uso de fluidos orais (saliva) como espécime para diagnóstico nos suínos. Esta técnica já foi validada experimentalmente para PRRSV, PCV2 e influenza, e está-se a utilizar de forma rotineira nos sistemas produtivos dos EUA para a detecção de PRRSV e influenza ao nível de efectivos animais. Brevemente, a técnica baseia-se em suspender uma corda de algodão num parque para que os porcos a mordam enquanto depositam a sua saliva nela (Prickett et al. 2008).
1. Recolha de amostras:

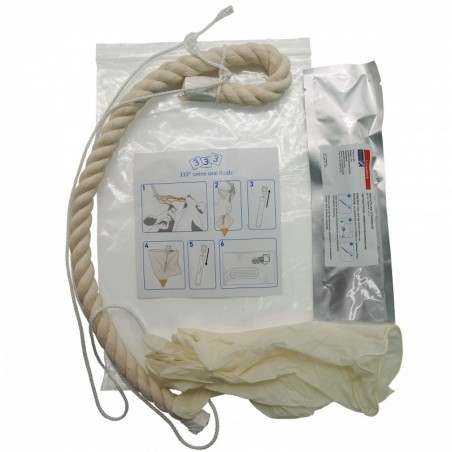
Materiais necessários: Corda de algodão 100% (não tratada com produtos químicos), tesouras, bolsas de plástico (tipo Zipplog ®) e tubos de plástico estéreis com base cónica ou arredondada e com capacidade suficiente para o volume da amostra (5cc, 10cc, ou 20cc).

Pontos chave:
- O número de cordas necessário para que as amostras sejam representativas dependerá do tamanho da população, da distribuição dos pavilhões, e do tamanho dos parques (considera-se que em pavilhões de uma só sala de 1000 animais, 6 cordas são suficientes para detectar 10% de prevalência com 95% de confiança (Detmer et al., 2010).
- O diâmetro da corda e a altura a que deve situar-se dependerá da idade dos animais, mas deve ser de fácil acesso para todo o grupo.
- Um periodo de tempo de 30 min é suficiente para que 75% dos animais contactem com a corda num parque de 25-30 animais, aumentando até 90% se durante o mesmo tempo, suspendermos duas cordas.
- Antes da recolha, comprovar que a corda está saturada de saliva (ajudará a determinar se o tempo foi suficiente).
2. Recolha da amostra:
Corta-se a parte húmida da corda e deposita-se na bolsa de plástico limpa. Procede-se à extracção da saliva como mostram as imagens e a amostra decanta-se nos tubos estéreis.
Precauções: A extracção da saliva deve realizar-se com a maior brevidade possível após a recolha das cordas e procurando manipular o menos possível a corda directamente com as mãos para evitar contaminações cruzadas. Refrigerar as amostras rapidamente.


3. Conservação:
- A sujidade das amostras (artefactos) pode interferir no resultado do diagnóstico. Por isso a saliva tem que ser centrifugada (1000-2000 rpm/30 min.) ou pelo menos, permitir durante 60 min. que as particulas de sujidade presentes na amostra se depositem no fundo do tubo. Com o sobrenadante, proceder à sua análise ou conservação.
- As amostras devem ser mantidas em refrigeração (4-10°C). A 4°C podem-se ter até 12 dias sem que por isso se veja alterada a detecção de PRRSV mediante PCR. Para a sua conservação as amostras devem ser congeladas (-20°C ou -80°C).
4. Análise:
A detecção de patógenos virais e bacterianos realiza-se mediante a Reacção em Cadeia da Polimerase (PCR). O RNA viral de PRRS e influenza podem ser detectados na saliva às 24 h. PI. A detecção de anticorpos contra a PRRSV e PCV2 pode-se realizar mediante o teste ELISA e supõe uma alternativa ao PCR para diminuir custos de diagnóstico. Contudo, o isolamento vírico de PRRSV e PCV2 ainda não se realiza e no caso da influenza, a percentagem de isolamento a partir de fluidos orais PCR positivos é de 51%.
5. Vantagens e limitações da técnica:
A monitorização de uma população mediante fluidos orais pode resultar num menor custo em diagnostico enquanto se aumenta o número de porcos da amostra, e no futuro, os patógenos que podem ser detectados.
A toma das amostras não requer pessoal especializado e além que a natureza curiosa dos porcos facilita a recolha da amostra, ao interagir e brincar com a corda enquanto depositam a saliva nela.
Com as amostras de fluidos orais conseguimos uma maior representatividade da população e a sensibilidade para detectar infecções de baixa prevalência (≤10%) é igual ou superior às tradicionais 30 amostras individuais.
As amostras de fluidos orais são representativas ao nível de população, mas nunca podem substituir as amostras individuais para o isolamento de um microorganismo.
É muito importante para evitar falsos negativos o evitar fazer pools das amostras e a verificação de que as amostras são processadas num laboratório familiarizado com as técnicas de diagnóstico na saliva.
Para mais informação consultar:
http://vetmed.iastate.edu/vdpam/disease-topics/oral-fluids
http://www.vdl.umn.edu/guidelines/oralfluids/home.html