Existem vários testes de laboratório que podem ser utilizados para o diagnóstico da pneumonia enzoótica (EP). A eleição do teste e o método de investigação dependem das circunstâncias clínicas e da justificação para os realizar.
Em termos gerais, as ferramentas de diagnóstico disponíveis classificam-se nas seguintes categorias:
|
1. Detecção do agente • Métodos baseados em testes moleculares (PCR) para detectar o ADN do M. hyopneumoniae no tecido pulmonar, esfregaços nasais ou lavados brônquicos. • Imunohistoquímica (IHC) para demonstrar a presença de antigenes M. hyopneumoniae em secções histológicas de lesões pulmonares. • Hibridação in situ (ISH) para demonstrar o ADN de M. hyopneumoniae em secções histológicas de tecido pulmonar. • Cultivo para detectar M. hyopneumoniae a partir de tecido pulmonar ou de outras amostras do aparelho respiratório. 2. Detecção de anticorpos • Exames serológicos para determinar a quantidade de anticorpos circulante para M. hyopneumoniae. |
||
Apesar de existir toda uma gama de métodos diagnósticos descritos, a disponibilidade destes testes varia de país para país, dependendo do nível de tecnologia existente, do objectivo de determinados laboratórios e dos interesses dos veterinários e dos cientistas que trabalham neles.
As políticas sobre testes de garantia sanitária no âmbito industrial e os métodos recomendados pelos principais veterinários de suínos também podem influir na disponibilidade dos diagnósticos oferecidos pelos laboratórios.
Cenários de diagnóstico

|
1) Suspeita de surtos agudos de EP numa exploração anteriormente negativa. Neste caso, o factor chave é a confirmação de se M. Hyopneumoniae foi ou não a causa do acontecimento. Isto pode ser comprovado enviando os porcos mortos ou porcos vivos afectados para o laboratório de diagnóstico para exame post mortem. O tecido pulmonar fresco pode ser examinado por PCR e serem conservadas amostras pulmonares para uma posterior confirmação, se necessário, mediante testes de IHC o ISH. |
||
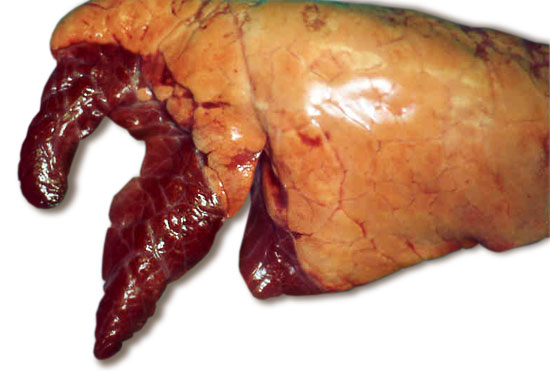
Fig 1. Aspecto típico de pulmões com pneumonia enzoótica. Os lóbulos pulmonares antero-ventrais escurecidos encontram-se consolidados pela infecção.
|
Além do exame post mortem, podem ser recolhidas amostras de porcos vivos afectados para testes de PCR. Segundo a minha experiência, os esfregaços de garganta obtidos correctamente, proporcionam uma taxa de sensibilidade diagnóstica mais elevada que os esfregaços nasais e o uso de uma técnica de PCR “aninhada” optimiza a sensibilidade do exame, o que o converte numa ferramenta de diagnóstico muito valiosa. Agrupando os esfregaços em lotes de 5 por grupo, consegue-se um número representativo de porcos para examinar de modo rentável. O primeiro conjunto de amostras de sangue para serología emparelhada pode ser recolhida no estado agudo; no caso ideal, os porcos dos quais foram obtidas amostras deveriam ser etiquetados para poderem ser comparadas correctamente as amostras de soro de porcos convalescentes obtidas 3-4 semanas mais tarde com as amostras do estado agudo considerando porcos individuais. 2) Diagnóstico de M. hyopneumoniae como parte do “complexo respiratório suíno” (CRP) Em situações de pneumonía complexa, na qual podem estar implicadas uma ou mais infecções concomitantes, aconselha-se ampliar a investigação e o protocolo de amostragem de modo que se inclua material para outros exames. Isto inclui tecido pulmonar fresco para bacteriologia e virologia e/ou exames de PCR para outros agentes. A histopatologia em 3 áreas representativas do tecido pulmonar proporciona uma melhor compreensão da natureza das lesões pneumónicas. Em casos crónicos de infecção por M. hyopneumoniae existem certas características que se podem descrever como altamente sugestivas do diagnóstico, mas as lesões não são verdadeiramente específicas, pelo que devem ser comunicadas com precaução. |
||
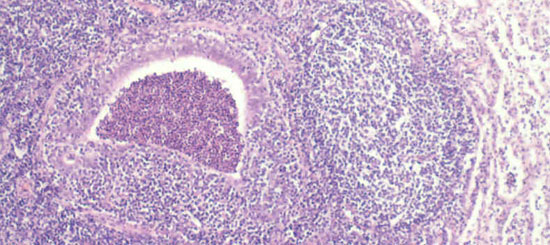
Fig 2. As reacções inflamatórias crónicas nas vias respiratórias e no seu redor são rasgos típicos da pneumonia enzoótica crónica.
|
Podem ser aplicados tecidos histopatológicos incluidos em parafina para IHC ou ISH para demonstrar a presença de agentes associados ás lesões. Devem ser incluidas vias aéreas ciliadas nos tecidos seleccionados para demonstrar a presença de M. hyopneumoniae mais eficazmente. Sempre que o CRP seja um problema crónico na exploração, podem ser realizados testes serológicos de amostras únicas para detectar a presença de M. hyopneumoniae e de outros agentes. 3) Triagem de porcos sãos para comprovar que estão isentos de M. hyopneumoniae como parte de um programa de garantia sanitária. Além da inspecção clínica das explorações e dos testes realizados nos pulmões de porcos abatidos, pode ser feita uma triagem para M. hyopneumoniae num número representativo de porcos em idades de alto risco (isto é, engorda ou acabamento) através de esfregaços de garganta, assim como com a recolha de amostras de sangue para serologia. É arriscado confiar apenas na serologia porque pode haver um atraso de 4-6 semanas até que haja números apreciáveis de porcos com anticorpos circulantes mensuráveis após a infecção. Os testes de PCR apresentam um alto grau de especificidade e permitem uma detecção mais precoce da infecção. Os testes de PCR também podem ser usados eficazmente em explorações isentas de EP que tenham sido vacinadas contra a possibilidade de doença grave, no caso de ter havido anteriormente uma crise numa exploração não infectada . Exactidão dos testes Devem ser tidos em conta os factores relativos à especificidade e sensibilidade dos testes sempre que se interpretem os resultados de laboratório. A especificidade dos exames ELISA, tanto a indirecta como a de bloqueio, para M. hyopneumoniae é boa, mas não a 100%. Sabe-se que se revelam resultados falsos positivos, mas isto pode-se manter num nível mínimo se os laboratórios dispuserem de bons procedimentos internos de controlo de qualidade e repetirem os exames das amostras que dão títulos positivos baixos, para comprovar a validade dos resultados. Ainda assim, os laboratórios que realizam os testes de PCR devem ter protocolos rigorosos para minimizar o risco de contaminação cruzada e de resultados falsos positivos, mais especialmente quando sejam utilizados métodos de PCR “aninhados” São precisos controles internos de PCR para evitar resultados falsos negativos. Os testes de IHC e de ISH são técnicas especializadas de histopatologia e a interpretação dos resultados é da competência exclusiva de peritos em patologia veterinária. A fluorescência ou a coloração não específicas podem ser confundidas com a fluorescência ou a marcação de agentes para diagnóstico, a não ser que os patologistas tenham experiência neste campo e sejam aplicados os controles adequados. Ainda que na lista de métodos de detecção tenha sido incluído o cultivo de M. hyopneumoniae, não é práctico no uso diagnóstico de rotina, devido a que tem uma taxa de crescimento muito lenta, são necessários meios especializados e a frequência com que M. hyopneumoniae é superado em crescimento por organismos comensais, habitualmente M. hyorhinis. Este gasto e a baixa sensibilidade de cultivo de M. hyopneumoniae faz dele pouco prático, a menos que se requeiram isolados especificamente para realizar testes de sensibilidade antimicrobiana. |
||



