Signos clínicos y hallazgos patológicos de las infecciones por PCV2, ¿cómo reconocerlos?
El circovirus porcino (en inglés, porcine circovirus, PCV) se describió por primera vez en 1974 como un contaminante de la línea celular PK-15 obtenida a partir de riñón de cerdo (Tischer et al., 1982; Tischer et al., 1974). Este virus se consideró inicialmente como no patógeno (Tischer et al., 1986). Más tarde, una variante del circovirus porcino fue aislado de cerdos afectados por el síndrome de desmedro multisistémico posdestete (SDMP, en inglés, postweaning multisystemic wasting syndrome, PMWS) (Allan et al., 1998; Ellis et al., 1998). La terminología circovirosis porcina designa específicamente el síndrome de desmedro multisistémico posdestete. La secuenciación de los dos virus mostró una divergencia genética significativa y de ahí que posteriormente el Comité Internacional de Taxonomía de los Virus (en inglés, International Committee on Taxonomy of Viruses, ICTV) sugirió llamar al PCV no patógeno como circovirus porcino tipo 1 (PCV1) y al nuevo virus asociado con la enfermedad clínica como circovirus porcino tipo 2 (PCV2) (Allan et al., 1999).
El síndrome de desmedro multisistémico posdestete, a partir del cual se aisló por primera vez el PCV2, se caracterizaba por retraso en el crecimiento, incremento de la mortalidad, ictericia y lesiones microscópicas características en múltiples órganos, principalmente en órganos linfoides (Clark, 1997; Rosell et al., 1999). Este síndrome, desde su aparición en Canadá en 1991, se extendió a los principales países productores de porcino del mundo. Actualmente, el PCV2 está reconocido como uno de los principales virus causantes de graves pérdidas económicas en el sector porcino a nivel mundial.
Tanto las características clínicas y patológicas de la circovirosis porcina como el papel desempeñado por la forma subclínica de la infección por PCV2 han ido evolucionando desde 1991. Además del síndrome de desmedro multisistémico posdestete, actualmente denominado enfermedad sistémica asociada a PCV2 (ES-PCV2) (Segalés, 2012), este virus está involucrado en otras patologías englobadas actualmente bajo el nombre de enfermedades asociadas a circovirus porcino tipo 2 (en inglés, porcine circovirus diseases, PCVD) (Allan et al., 2002).
El objetivo de este artículo de revisión es actualizar los signos clínicos y las patologías causadas por la infección de PCV2, así como su diagnóstico. Actualmente, este tema ha recuperado importancia. A pesar de que las vacunas frente a PCV2 tienden a funcionar muy bien, es importante que ante una sospecha de potencial fallo vacunal se utilicen los criterios diagnósticos de la enfermedad de manera adecuada y precisa.
CARACTERÍSTICAS CLÍNICAS Y PATOLÓGICAS
Infección subclínica por PCV2
En la actualidad, se ha controlado el desarrollo de las enfermedades asociadas a PCV2 clínicas mediante vacunación frente a PCV2, hasta el punto en que hoy en día aparecen muy pocos casos nuevos. Estas vacunas han logrado disminuir los brotes de ES-PCV2 pero no han conseguido eliminar la infección por PCV2. Por tanto, la infección por PCV2 continua siendo prácticamente ubicua (Segalés et al., 2005). Ello implica que la mayoría de los cerdos que se infectan lo hacen de forma subclínica, traduciéndose generalmente en un menor crecimiento de estos animales sin manifestaciones clínicas evidentes (tabla 1). De hecho, las consecuencias de esta infección se hacen evidentes cuando se comparan animales vacunados y no vacunados en una granja con infección subclínica (Young et al., 2011).
Infección clínica por PCV2
Desde el punto de vista clínico-patológico, los principales procesos patológicos englobados dentro de las PCVD son la enfermedad sistémica (ES-PCV2), la enfermedad reproductiva (ER-PCV2) y el síndrome de dermatitis y nefropatía porcino (SDNP) (Segalés, 2012). En la tabla 1 se muestran los principales hallazgos clínicos y patológicos de las mismas, así como la cantidad de PCV2 normalmente detectada en estas lesiones.
Enfermedad sistémica por PCV2 (ES-PCV2)
La ES-PCV2 es una enfermedad multifactorial, en la que la infección por PCV2 es necesaria pero no suficiente, ya que para que se lleve a cabo su expresión también se requiere la presencia de otros factores (Madec et al., 2008; Segalés et al., 2005).
■ Signos clínicos: esta enfermedad se observa en cerdos entre 30 y 180 días de edad, y se da un mayor número de casos a edades comprendidas entre los 60 y 90 días. La morbilidad observada en las granjas afectadas suele estar entre 4-30 % (ocasionalmente 50-60 %) y la mortalidad varía de 4 % a 20 % (Segalés y Domingo, 2002). La ES-PCV2 se caracteriza clínicamente por pérdida de peso (figura 1), palidez de la piel, distrés respiratorio, diarrea y, ocasionalmente, ictericia (Harding y Clark, 1997).

Figura 1. Cerdo afectado por la ES-PCV2 al lado de un cerdo sano de la misma edad. En el animal afectado se observa un claro retraso en el crecimiento.
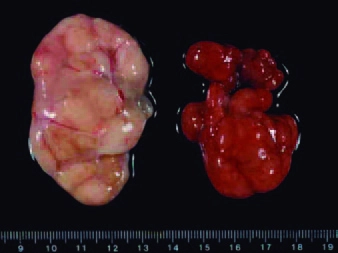
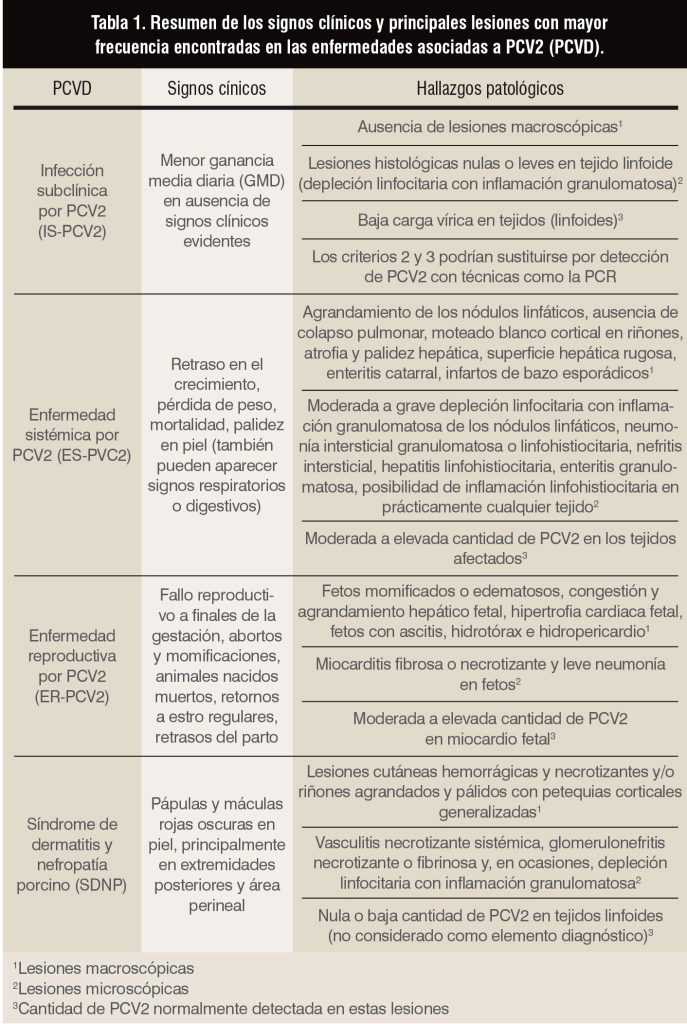
Figura 2. Apariencia macroscópica de un nódulo linfático inguinal superficial (izquierda) y submandibular (derecha) de un animal con ES-PCV2. En ambos se observa un marcado incremento de tamaño.
■ Hallazgos patológicos: las lesiones se encuentran principalmente en los tejidos linfoides. En la fase inicial de la ES-PCV2, los nódulos linfáticos se encuentran aumentados de tamaño (figura 2), mientras que en las fases más avanzadas de la enfermedad suelen encontrarse con un tamaño normal o incluso atrofiados (Clark, 1997; Segalés et al., 2004). También se suele observar una atrofia de timo en los animales afectados (Darwich et al., 2003; Hansen et al., 2013). Estos resultados corresponden microscópicamente a una depleción linfocitaria con infiltración de células histiocíticas grandes y células gigantes multinucleadas (figura 3) (Clark, 1997; Rosell et al., 1999), así como una atrofia cortical del timo (Darwich et al., 2003).
Figura 3. Histología de los nódulos linfáticos de un cerdo sano (normal) y de animales afectados por la ES-PCV2 con distinta intensidad lesional (leve, moderada y grave). Lesiones de depleción linfocitaria e infiltración histiocitaria moderadas y graves se asocian con la ES-PCV2. Tinción de hematoxilina-eosina.
Los pulmones pueden estar agrandados, no colapsados y de consistencia elástica. Microscópicamente se observa una neumonía intersticial y, en casos más avanzados, también hay presencia de fibrosis peribronquial y bronquiolitis fibrinosa (Clark, 1997; Segalés et al., 2004). El hígado también puede estar atrofiado, pálido, firme y con superficie rugosa. Las lesiones microscópicas en hígado pueden variar, desde leve hepatitis linfohistiocitaria hasta inflamación masiva con desorganización de los cordones hepáticos (Rosell et al., 2000a).
A veces se pueden observar manchas blancas en la corteza renal que corresponden a una nefritis intersticial no purulenta. La inflamación linfohistiocitaria se puede observar en casi cualquier tejido de los animales afectados por la ES-PCV2 (Segalés et al., 2004).
Enfermedad reproductiva asociada a PCV2 (ER-PCV2)
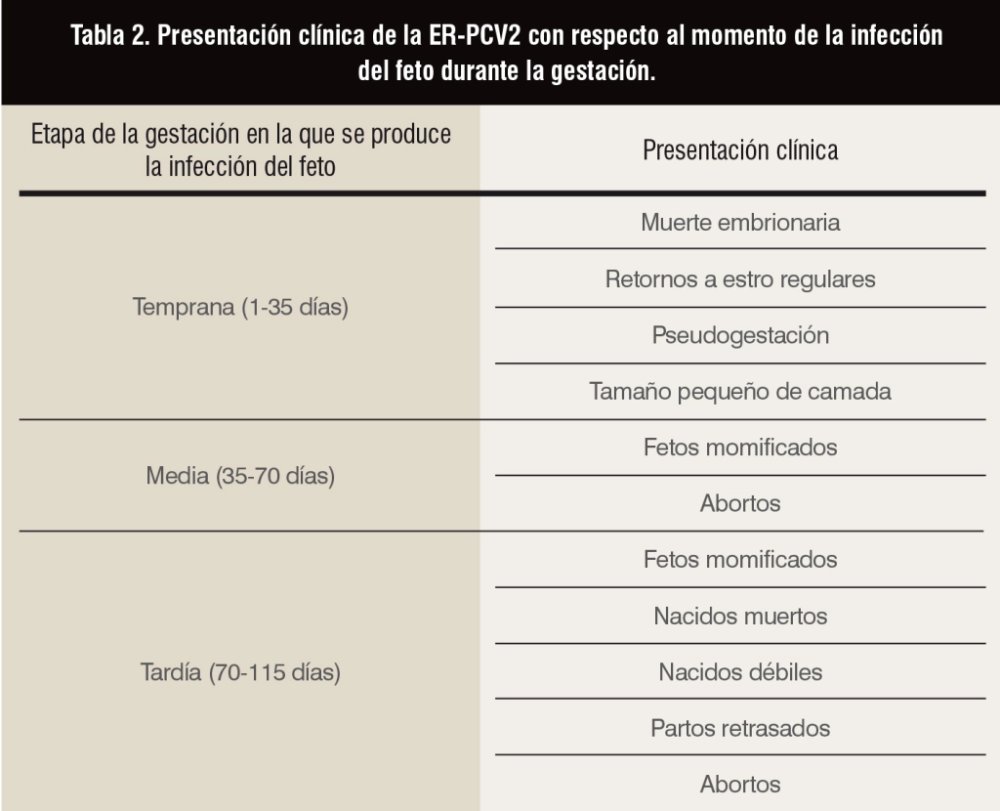
■ Signos clínicos: la manifestación clínica de la infección por PCV2 durante la gestación es variable, ya que depende del momento en el que se produce la infección viral, de la respuesta inmunitaria y de la duración de la viremia en la hembra. En la tabla 2 se resumen las distintas presentaciones clínicas del fallo reproductivo asociado a PCV2 con respecto al momento de la infección del feto durante la gestación (Madson y Opriessnig, 2011).
La presentación clínica más común de la ER-PCV2 es el incremento de los fetos nacidos muertos y momificados durante el parto (O’Connor et al., 2001). Los signos clínicos de la ER-PCV2 en la cerda generalmente están ausentes o son inaparentes. Sin embargo, puede haber un porcentaje bajo de abortos debido a un proceso sistémico, mostrando fiebre y anorexia (Cariolet et al., 2002; Park et al., 2005).
Además, existen estudios que demuestran que el PCV2 podría estar asociado con situaciones de retorno al estro, presumiblemente debido a una replicación del virus en los embriones y la consecuente muerte embrionaria (Mateusen et al., 2007). Otros rasgos clínicos asociados con la ER-PCV2, aunque descritos muy raramente, son el retraso del parto (>118 días de gestación) y la pseudogestación (Madson y Opriessnig, 2011). La manifestación clínica de la infección por PCV2 en la cerda es muy variable. Por lo tanto, la infección por PCV2 debe estar incluida en el diagnóstico diferencial de cualquier problema reproductivo observado en hembras de una granja.
■ Hallazgos patológicos: en la ER-PCV2 no siempre se observan lesiones macroscópicas fetales (Madson et al., 2009a, b). Con frecuencia, la única indicación de esta enfermedad es el incremento del número de fetos nacidos muertos y momificados en el parto. Cuando están presentes, se observa cardiomiopatía dilatada con regiones de palidez, miocarditis fibrosonecrotizante, neumonía con edema pulmonar, hepatomegalia con un patrón lobulillar acentuado, hidrotórax, ascitis y edema subcutáneo (Madson et al., 2009c; O’Connor et al., 2001).
También se puede observar, con mucha menos frecuencia, linfadenopatía generalizada, atrofia de timo, edema perirrenal y petequias cerebrales y esplénicas en los fetos (Madson et al., 2009c).
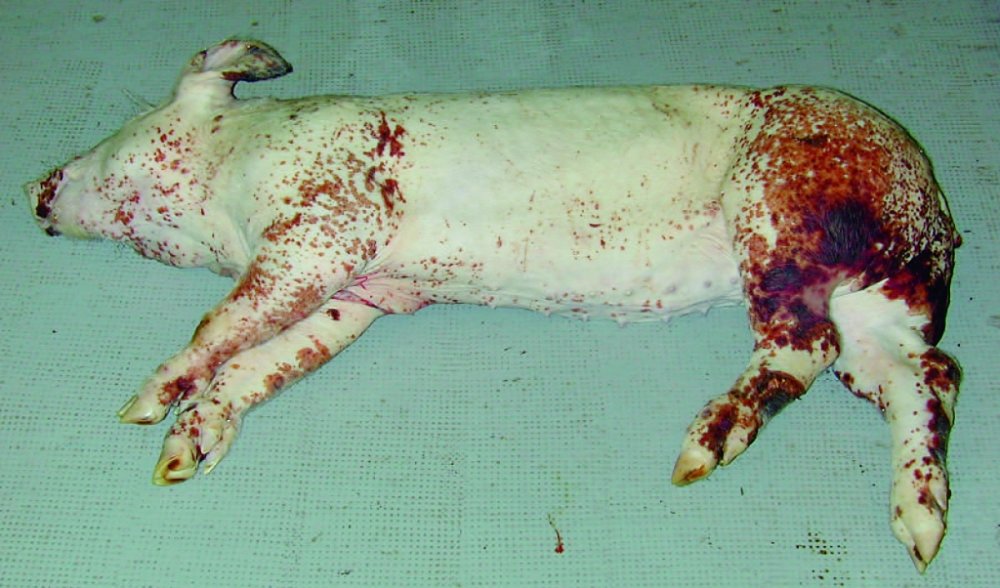
Figura 4. Cerdo afectado por el SDNP. Presencia de pápulas y máculas de color rojo oscuro distribuidas irregularmente sobre la piel del animal. Éstas son más intensas en las extremidades posteriores y zona perineal.
Síndrome de dermatitis y nefropatía porcino
■ Signos clínicos: el síndrome de dermatitis y nefropatía porcino (SDNP) puede afectar tanto a cerdos de transición y engorde como a los adultos (Drolet et al., 1999), aunque su prevalencia es habitualmente muy baja (Segalés et al., 1998). Los animales afectados gravemente (especialmente a nivel de riñón) suelen morir a los pocos días después de la aparición de los signos clínicos. Los cerdos supervivientes tienden a recuperarse y ganar peso 7-10 días después del comienzo del síndrome (Segalés et al., 1998). Los cerdos afectados están deprimidos, son reacios a moverse y presentan rigidez al andar, por lo que suelen estar tumbados; en casos más crónicos, estos animales pueden estar caquécticos (Drolet et al., 1999). El hallazgo clínico característico del SDNP es la presencia de máculas y pápulas de color rojo oscuro distribuidas irregularmente sobre la piel de las extremidades posteriores y zona perineal, aunque también pueden distribuirse de manera generalizada (figura 4). Con el tiempo, y si el animal sobrevive, estas lesiones se van convirtiendo en costras oscuras y van desapareciendo poco a poco, aunque a veces pueden dejar cicatrices (Drolet et al., 1999).
■ Hallazgos patológicos: microscópicamente, las máculas y pápulas son observadas como piel hemorrágica y necrótica junto con vasculitis necrotizante (Segalés et al., 1998). Los cerdos afectados gravemente por el SDNP presentan unos riñones aumentados de tamaño, petequias rojizas corticales y edema de la pelvis renal (Segalés et al., 2004). Estas lesiones corresponden a una glomerulonefritis necrotizante o fibrinosa con nefritis intersticial no purulenta. El SDNP, aparte de las lesiones en piel y riñón, también puede presentar nódulos linfáticos agrandados e infartos esplénicos (Segalés et al., 1998). Histopatológicamente, se pueden observar lesiones linfoides similares a las de la ES-PCV2 (Rosell et al., 2000b), aunque generalmente de intensidad leve o moderada.
A pesar de que existe una serie de circunstancias que asocian al PCV2 con el SDNP, actualmente no se ha establecido una relación causal entre el agente y la enfermedad. La patogénesis de las lesiones características del SDNP se atribuye a una reacción de hipersensibilidad tipo III y en la mayoría de estas lesiones no se ha podido detectar la presencia de PCV2. Por lo tanto, hoy en día, la detección de PCV2 no es una condición obligatoria para el diagnóstico del SDNP. Es cierto, no obstante, que desde que se usan masivamente las vacunas frente a PCV2, la prevalencia del SDNP ha disminuido hasta niveles prácticamente indetectables.
Otras enfermedades asociadas a PCV2
Dentro de este grupo se incluyen la enfermedad pulmonar (EP-PCV2) y enfermedad entérica (EE-PCV2) (Segalés, 2012). Aunque en la bibliografía publicada se suele incluir estas dos enfermedades dentro del grupo de las PCVD, es cierto que la sintomatología respiratoria y digestiva encontrada en estas enfermedades también puede estar presente en la ES-PCV2 (Opriessnig et al., 2007). Estas patologías sólo se pueden diferenciar de la ES-PCV2 mediante histología de pulmón, intestino y tejidos linfoides. De esta manera, tanto para el diagnóstico de las formas pulmonar como entérica se deberían observar lesiones microscópicas en pulmón e intestino, respectivamente, pero no en tejidos linfoides, ya que si fuera así se trataría de la forma sistémica.
DIAGNÓSTICO LABORATORIAL
Debido a que la infección por PCV2 es ubicua, el diagnóstico no se puede basar solamente en la detección del agente o de animales seropositivos. El diagnóstico de las enfermedades asociadas a PCV2 debe estar basado en tres criterios básicos: presencia de signos clínicos, presencia de lesiones compatibles con PCVD y detección del virus dentro de estas lesiones (Segalés et al., 2005).
Con el fin de detectar el virus o su genoma en diferentes tejidos, se han desarrollado varios métodos. La hibridación in situ (HIS) (figura 5), inmunohistoquímica (IHQ) y PCR son las pruebas más utilizadas para el diagnóstico de las enfermedades asociadas a PCV2 (Rosell et al., 1999). No obstante, la ubicuidad de la infección conlleva a que el uso de la PCR sin la aplicación de criterios patológicos pueda ser equívoca en un número significativo de casos.
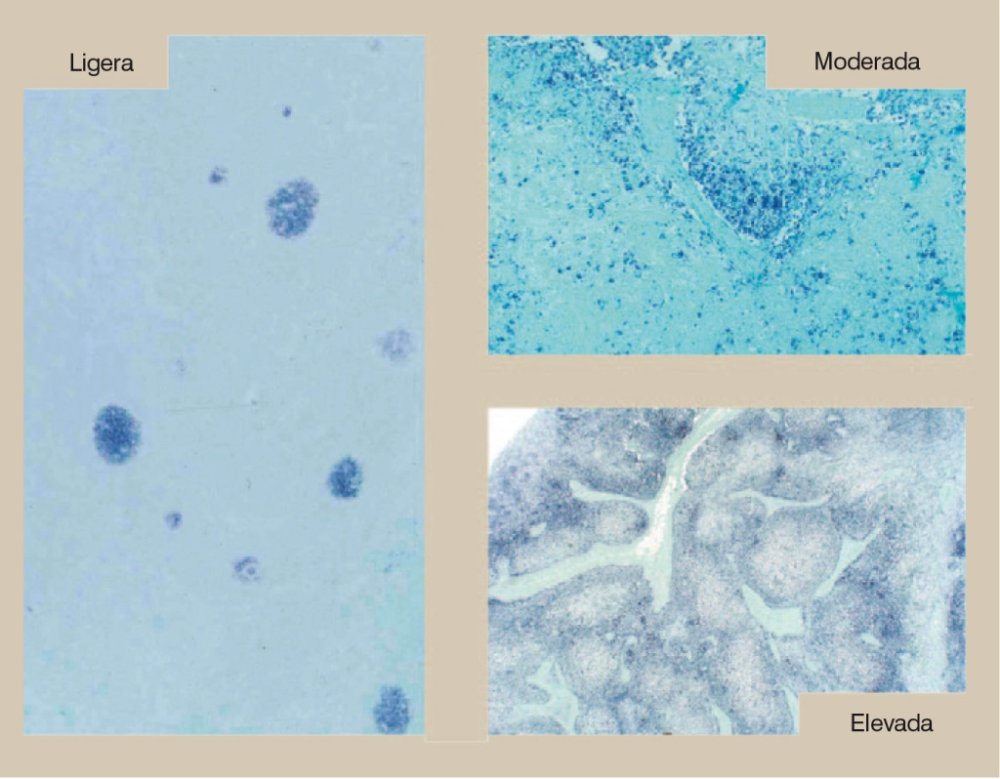
Figura 5. Hibridación in situ para la detección de PCV2 en nódulos linfáticos. Ligera, moderada o elevada presencia de ácido nucleico de PCV2 en el citoplasma de las células gigantes multinucleadas y macrófagos (células teñidas de color azul oscuro) de animales afectados por la ES-PCV2. Cantidades moderadas y elevadas se asocian con la ES-PCV2. Contratinción con fast green.
Existe una clara correlación entre la cantidad de PCV2 observada en tejidos y la gravedad de las lesiones linfoides microscópicas en la ES-PCV2 (Rosell et al., 1999). Puesto que la diferencia principal entre animales con infección clínica y subclínica es la cantidad de PCV2 en tejidos afectados, las técnicas que permiten la cuantificación del PCV2 en tejidos y/o suero son muy utilizadas para el diagnóstico de dicha enfermedad (Olvera et al., 2004). Sin embargo, la PCR cuantitativa es un buen método para el diagnóstico de ES-PCV2 a nivel poblacional, pero a nivel individual se tiene que combinar con criterios patológicos (Grau-Roma et al., 2009).
También se han desarrollado técnicas serológicas para la detección de anticuerpos frente a PCV2 (Segalés y Domingo, 2002). Pero el uso de estas técnicas no está enfocado específicamente al diagnóstico de las enfermedades asociadas a PCV2, ya que la gran mayoría de animales seropositivos son clínicamente sanos.
Estos métodos se utilizan frecuentemente para la observación de la dinámica de anticuerpos frente a PCV2 durante el seguimiento de un programa vacunal (Fachinger et al., 2008), para el desarrollo de estudios epidemiológicos y para la evaluación de la interferencia de la inmu nidad materna con la vacunación (Fort et al., 2009).
DISCUSIÓN
Más de 15 años después de las primeras descripciones de la ES-PCV2 (Allan et al., 1998; Ellis et al., 1998), los mecanismos exactos por los cuales un cerdo infectado con PCV2 desarrolla una enfermedad clínica o subclínica siguen sin conocerse con precisión (Kekarainen et al., 2010). No obstante, se conoce que el hospedador, el momento de la infección y el genotipo del PCV2, son factores fundamentales a tener en cuenta para explicar la presentación de la enfermedad a nivel individual (Segalés et al., 2013). Los estudios clínicos y patológicos realizados han sido esenciales para la descripción y caracterización de las enfermedades asociadas a PCV2, y nos han permitido ahondar en el conocimiento sobre la patogénesis de estas enfermedades (Segalés et al., 2004). Además, las características clínicas y patológicas de las infecciones por PCV2 se han ampliado desde los años 90 y, en la actualidad, cada uno de los procesos patológicos englobados dentro de las enfermedades asociadas al circovirus porcino siguen criterios diagnósticos concretos (Segalés, 2012).
Desde 2007, se vienen utilizando con éxito en granjas de todo el mundo varias vacunas comerciales, reduciendo significativamente las pérdidas económicas causadas por la forma sistémica y subclínica de PCV2 (Kekarainen et al., 2010). Actualmente, la utilización masiva de estas vacunas ha contribuido al control del desarrollo de la enfermedad clínica, hasta el punto en que hoy en día estos casos se presentan en contadas ocasiones. A pesar de ello, la infección subclínica por PCV2 es habitual en granjas comerciales, y de forma ocasional se generan casos que, aunque están presentes en animales vacunados, son compatibles con una ES-PCV2. Es especialmente en estos últimos escenarios donde la aplicación de los criterios diagnósticos de la enfermedad vuelve a tomar relevancia para el veterinario clínico.
REFERENCIA
Oliver-Fernando S, Sibila M, Segalés J, Signos clínicos y hallazgos patológicos de las infecciones por PCV2, ¿cómo reconocerlos?, SUIS.2014; N°107: 14 – 20.
Para más información, haz click aquí












